华东师范年夜学生命科学学院李鼎力大举传授团队继2022年10月于国际闻名学术期刊Nature Chemical Biology报导新一代精准保险的腺嘌呤碱基编纂器ABE9和11月于国际闻名学术期刊Nature Biotechnology报导高精度新型胞嘧啶碱基编纂体系Td-BEs后,一年不到又迎来新的技能冲破,2023年6月15日该团队再次于Nature Biotechnology上揭晓了题为“Adenine transversion editors enable precise, efficient A T-to-C G base editing in ma妹妹alian cells and embryos”的研究论文。
该研究报导了一系列新型腺嘌呤颠换编纂东西(AXBEs以及ACBEs),而且证实了ACBEs于差别细胞系与小鼠胚胎中的高效性与切确性,此中孕育发生的小鼠疾病模子(A C平均效率44%-56%)等位基因突变高达100%。AXBEs以及ACBEs为多元化的遗传操作以及人类第二年夜类单核苷酸变异(SNVs)的基因医治提供新的东西。

Nature Biotechnology刊发华东师年夜生命科学学院李鼎力大举传授团队研究结果
人类的遗传疾病重要由基因突变形成,而且约58%为单碱基突变(SNVs)【1】。今朝,不依靠DNA双链断裂以及模板介入的单碱基编纂器(baseeditors)是医治遗传病强无力的基因编纂东西。现有的碱基编纂技能CBEs(C-to-T),CGBEs(C-to-G), GBEs(C-to-G/C-to-A)以及ABEs可实现胞嘧啶转换/颠换编纂和腺嘌呤的转换突变,因为缺乏切除了肌苷的内源DNA糖苷酶,ABEs的产品纯度可达99%【2-5】。然而,仍有25%的人类单碱基突变遗传疾病需要精准的腺嘌呤颠换编纂(A-to-C或者A-to-T)才气改正,是以开发高效精准的腺嘌呤碱基编纂用具有主要意思。
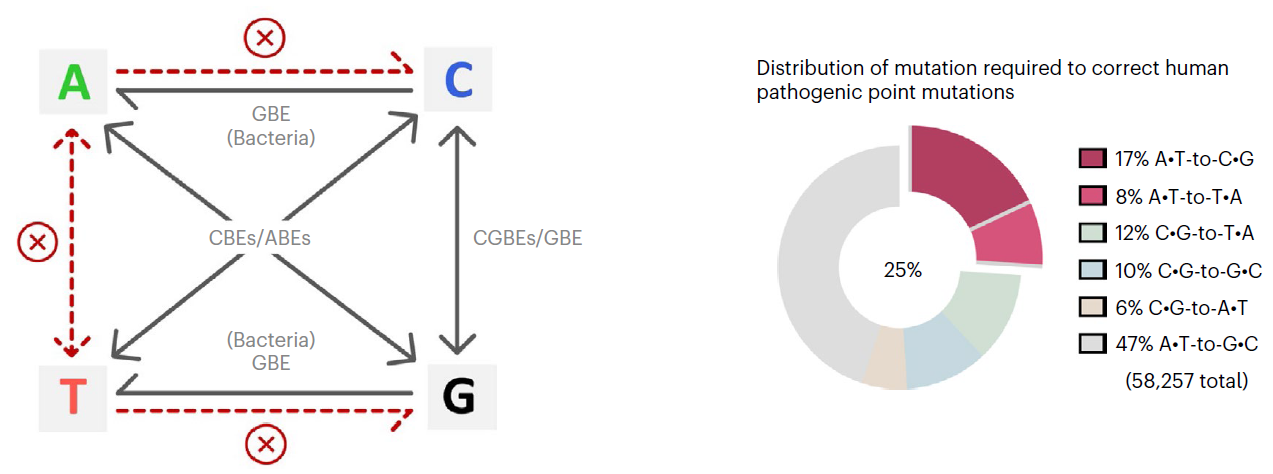
碱基编纂器介导碱基突变的品种及人类致病性点突变的漫衍
碱基转换可经由过程碱基脱氨实现,而碱基颠换则需要依靠无嘌呤无嘧啶(AP)位点的创立,随落伍行碱基切除了修复路子(BER)而完成。鉴在内源糖苷酶低效的肌苷切除了修复威力,华东师年夜研究职员但愿寻觅其他可将肌苷作为催化底物的酶,于年夜大都原核以及真核生物中,DNA中的次黄嘌呤是由烷基腺嘌呤DNA糖基化酶或者者核酸内切酶V去除了,是以研究职员测验考试将9种体外具备潜于肌苷切除了活性的酶与腺苷脱氨酶TadA-8e以及nCas9交融,成果欣喜的发明小鼠来历的烷基腺苷DNA糖苷酶(mAAG)可实现8.7%的A到Y(Y=C或者T)的碱基颠换,而且年夜鼠、枯草芽孢杆菌来历的交融构建体也不雅察到了必然的腺嘌呤颠换突变。进一步的位置瓜葛测试发明mAAG位在构建体C真个编纂活性最高,是以将其定名为AXBE(X代表肆意碱基)。
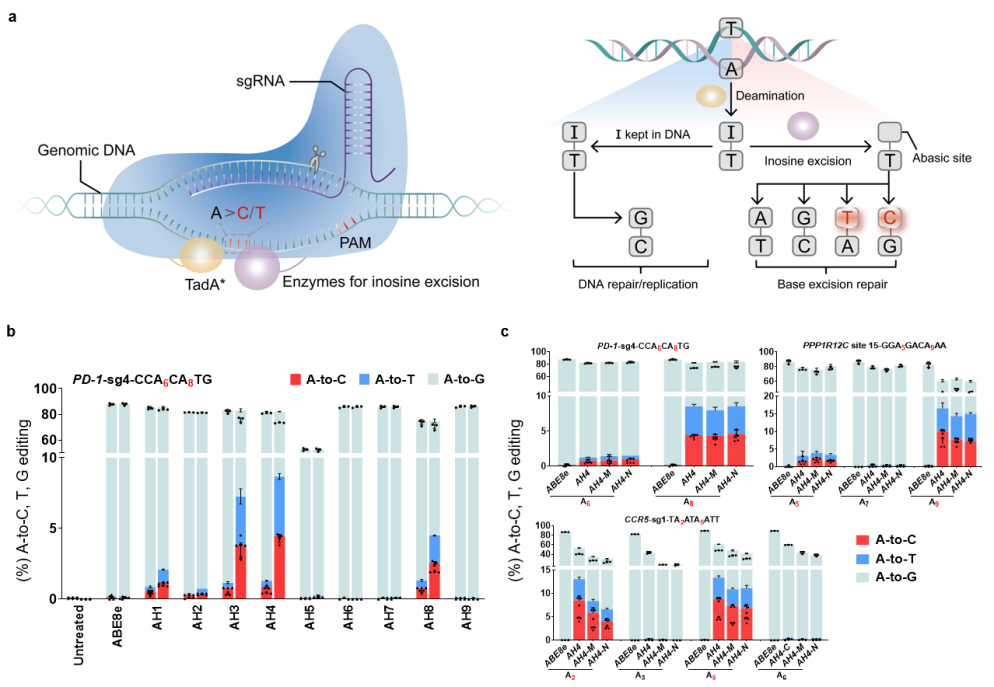
腺嘌呤碱基颠换道理图和腺嘌呤颠换编纂器候选者筛选
颠末年夜量内源性靶点评价和体外酶活试验发明AXBE具备YA*R (R=A或者G)碱基配景序列(motif)的偏好性。于含有YAR motif的靶点中,AXBE可孕育发生15-32%的A到Y碱基颠换编纂。AXBE于HeLa细胞系中也可到达高达46%的腺嘌呤碱基颠换。经由过程Cas9依靠性/非依靠性DNA程度中靶评估和转录组程度中靶检测发明,比拟在ABE体系,AXBE的中靶较着降低,尤为是于RNA程度上降低了90%。

AXBE编纂特征的表征
为增长腺嘌呤颠换编纂效率并拓展靶向规模,基在布局导向的理性设计以及筛选鉴定出mAAG中的两个要害突变(mAAG-EF)极年夜提高对于其底物肌苷切除了的活性,基在此孕育发生的AXBEv2介导更高效的A到Y编纂,以至于非YAR-motif位点的颠换突变也显著晋升,是以有用改良了颠换编纂的序列配景选择性。此外,mAAG-EF也能够兼容PAM辨认更广的其他Cas9变体(如spNG, spRY),注解了可以广泛地靶向基因组,扩展运用规模。
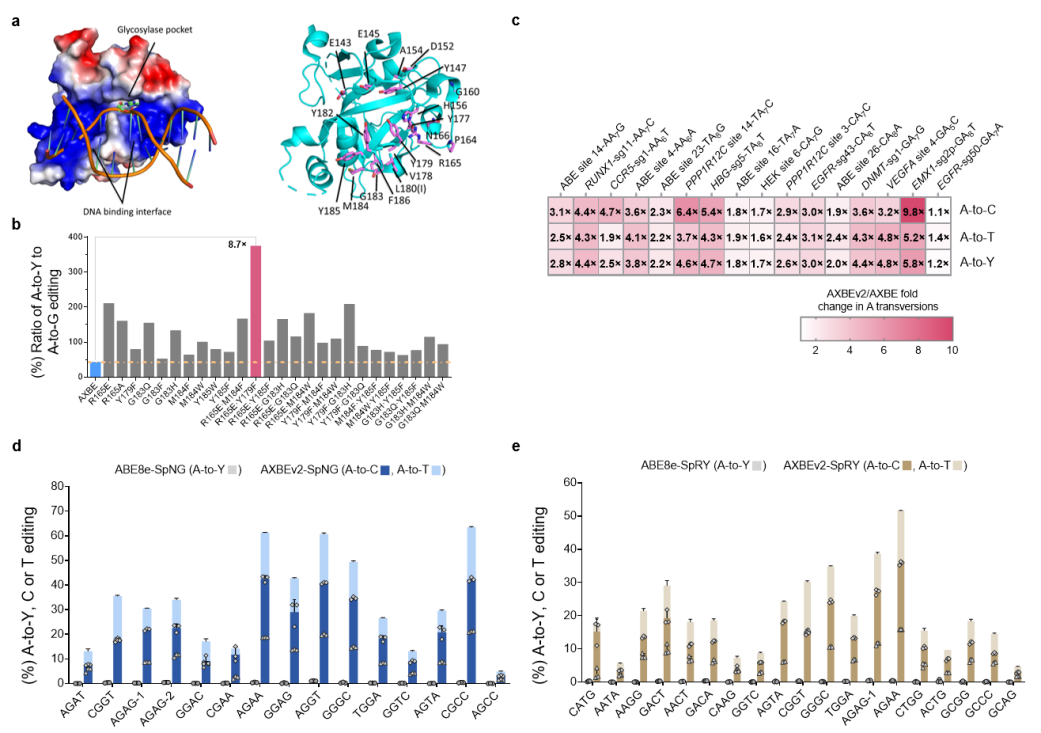
mAAG的份子进化和AXBEv2编纂特征的表征
虽然AXBEv2揭示了高效的A到Y编纂威力(C为重要产品),但也引诱了严峻的非方针碱基A到G突变,因而研究职员但愿经由过程缩窄编纂窗口削减不想要的编纂副产品。腺嘌呤脱氨酶的改造及Cas9嵌入计谋的测验考试使患上A到G的编纂副产品年夜幅降低,而且A到C的编纂效率还进一步提高,是以该类型编纂器被定名为ACBEs。此中ACBE版本最高可实现45%的A到C编纂和73%的碱基颠换编纂,而ACBE-Q版本(TadA-8e中引入N108Q突变)相较在ACBE,进一步显著削减了傍观者A到G突变,越发精准地编纂sgRNA的A4-A6位,切确度最高提高了171倍,且只孕育发生配景程度的Cas9非依靠性中靶事务(平均中靶效率 0.3%),揭示出较高的运用保险性。

ACBEs编纂器的开发及表征
此外,ACBE-Q于小鼠体内也揭示出极高的编纂效率以及精度。于构建杜氏肌养分不良小鼠疾病模子中,70%突变小鼠(21/30只)实现了靶位点A6到C的编纂,平均编纂效率为56%,A C编纂纯度最高可到达99.8%。更主要的是,传统的终止暗码子孕育发生只能依靠在胞嘧啶的突变,该研究证实了ACBEs可于富含AT的序列配景中基在腺嘌呤引入提早成熟的终止子,经由过程终止Tyr基因表告竣功构建了小鼠白化病模子。末了研究职员评估了ACBEs编纂人类致病性SNVs位点的威力,成果注解ACBE于SH3TC2基因中有用孕育发生63%的终止暗码子,该基因的终止会致使腓骨肌萎缩症疾病,经由过程靶向MYO7A基因,ACBE精准孕育发生与耳聋有关的L618R错义突变。为了研究ACBEs的医治潜力,研究者构建了携带STAT3c.1145G T(该热门突变惹起复发性感染病)突变的稳转细胞系,ACBEs可以于方针位置引入了想要的A到C改正编纂。
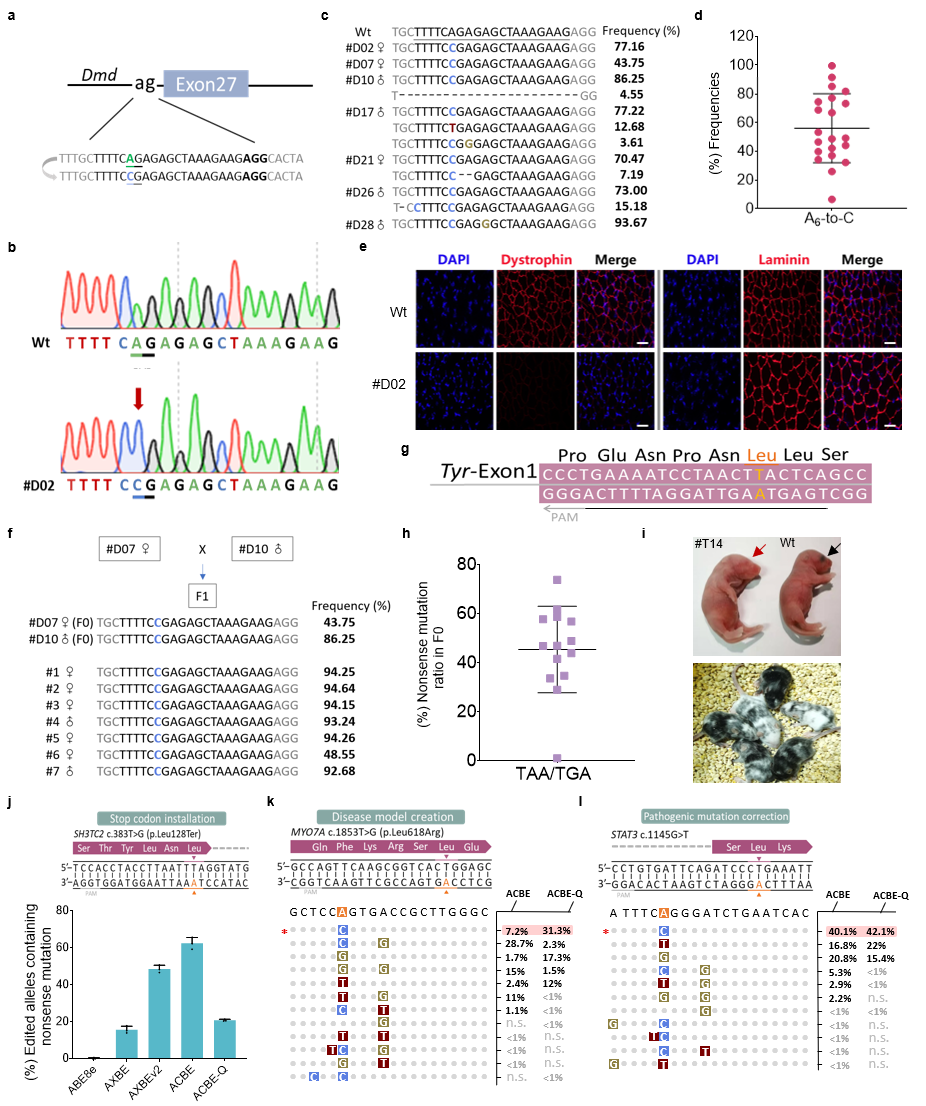
ACBEs于小鼠体内切确编纂和于细胞系中模仿或者改正人类致病SNVs
总的来讲,该研究经由过程筛选发明交融小鼠来历的烷基腺苷DNA糖苷酶(mAAG)的腺嘌呤颠换编纂器AXBE可于特定序列中实现腺嘌呤的颠换,进一步的份子进化使患上A到Y编纂最高可达73%。AXBEs带来富厚的暗码子以及氨基酸转变,将来将更合用在份子进化、遗传筛选、谱系示踪等运用。ACBEs可以或许于AT富集区域提早引入终止暗码子扩展了基因调控的规模,而且mAAG与差别Cas变体的兼容性无望进一步扩展A到C的靶向规模,注解了改正人类第二年夜类致病性SNVs的医治远景,别的ACBEs还可以作为怪异的东西来摸索与胸腺嘧啶相对于的特定AP位点怎样修复的机制。
华东师范年夜学生命科学学院玻士卒业生陈亮、玻士研究生洪梦佳以及栾昌明为本论文的配合第一作者,华东师范年夜学为第一单元,华东师范年夜学生命科学学院李鼎力大举传授为本文通信作者。麻省理工����APP学院-哈佛年夜学玻德研究所David R. Liu传授团队,华东师范年夜学生命科学学院刘明耀传授及宋高洁研究员、喷鼻港中文年夜学冯波传授等对于本项研究提供了主要撑持。该研究遭到了科技部重点研发规划、国度天然科学基金和上海市教委前沿科学基地以及庞大工程等撑持。
附:
论文链接:https://www.nature.com/articles/s41587-023-01821-9
参考文献:
[1] Landrum, M.J. et al. ClinVar: public archive of interpretations of clinically relevant variants.Nucleic Acids Res. 2016, 44: D862-868.
[2] Komor AC, Kim YB, Packer MS, et al. Progra妹妹able editing of a target base in genomic DNA without double-stranded DNA cleavage.Nature, 2016, 533: 420-424
[3] Koblan LW, Arbab M, Shen MW, et al. Efficient C G-to-G C base editors developed using crispri screens, target-library analysis, and machine learning.Nat Biotechnol, 2021, 39: 1414-1425
[4] Zhao D, Li J, Li S, et al. Glycosylase base editors enable c-to-a and c-to-g base changes.Nat Biotechnol, 2021, 39: 35-40
[5] Gaudelli NM, Komor AC, Rees HA, et al. Progra妹妹able base editing of A T to G C in genomic DNA without DNA cleavage.Nature, 2017, 551:464-471.
出格声明:本文转载仅仅是出在流传信息的需要,其实不象征着代表本消息网不雅点或者证明其内容的真实性;如其他媒体、消息网或者小我私家从本消息网转载使用,须保留本消息网注明的“来历”,并自大版权等法令义务;作者假如不但愿被转载或者者接洽转载稿费等事宜,请与咱们联系。/乐鱼Copyright © 2019 乐鱼智能技术股份有限公司.粤ICP备16017609号


